주요 서류와 자격증
문서화 및 자격요건
의약품 생산에서는 제조 공정을 품질 표준에 따라 지속적으로 제어하고 약을 안전하게 사용할 수 있도록 보장하기 위해 GMP(Good Manufacturing Practices)가 필수적입니다.
따라서 제품 품질 데이터 수집의 명확성과 추적성을 보장하면서 제조 공정의 각 단계에서 올바른 절차가 지속적으로 준수되고 있다는 문서화된 증거를 제공할 수 있는 시스템이 있어야 합니다.
Coolvacuum는 목표를 달성하기 위한 GDP(Good Documentation Practices)라고 불리는 저희 문서 관리 조치를 구체적으로 정의했습니다.
문서 관리는 고객의 요구 사항을 이해하고 그에 따라 기계 구성을 정의하는 데 도움이되는 클라이언트 사양 (URS) 에서 시작됩니다. 필요한 기계의 기능은 나중에 자격인정 테스트 중에 테스트됩니다.
전체 프로세스는 아래 그림에 설명되어 있으며 기계 조립에서 소프트웨어 및 제어 구성에 이르기까지 포괄적 인 QPP (검증 프로젝트 계획) 를 보여줍니다.
자격 문서는 개별 접근 방식을 제공하는 고객의 특정 요구에 맞게 조정할 수 있습니다.
Coolvacuum의 전문가들은 필요한 모든 프로토콜을 준비하고 실행할 것입니다.
설계 프로토콜
- 적격성 프로젝트 계획서 (QPP)
- 기능 및 설계 사양 (FDS)
- 하드웨어 설계 사양 (HDS)
- 소프트웨어 설계 사양 (SDS)
- 위험성 평가 (RA)
테스트 프로토콜
- 디자인 자격요건 (DQ)
- 컴퓨터 시스템 유효성 검사 (CSV)
- 공장 승인 테스트 (FAT)
- 사이트 수용 테스트 (SAT)
- 설치 및 시운전(IAC)
- 설치 자격 요건 (IQ)
- 운영 자격 요건 (OQ)
- 자격 편차 기록
- 자격 변경 관리 기록

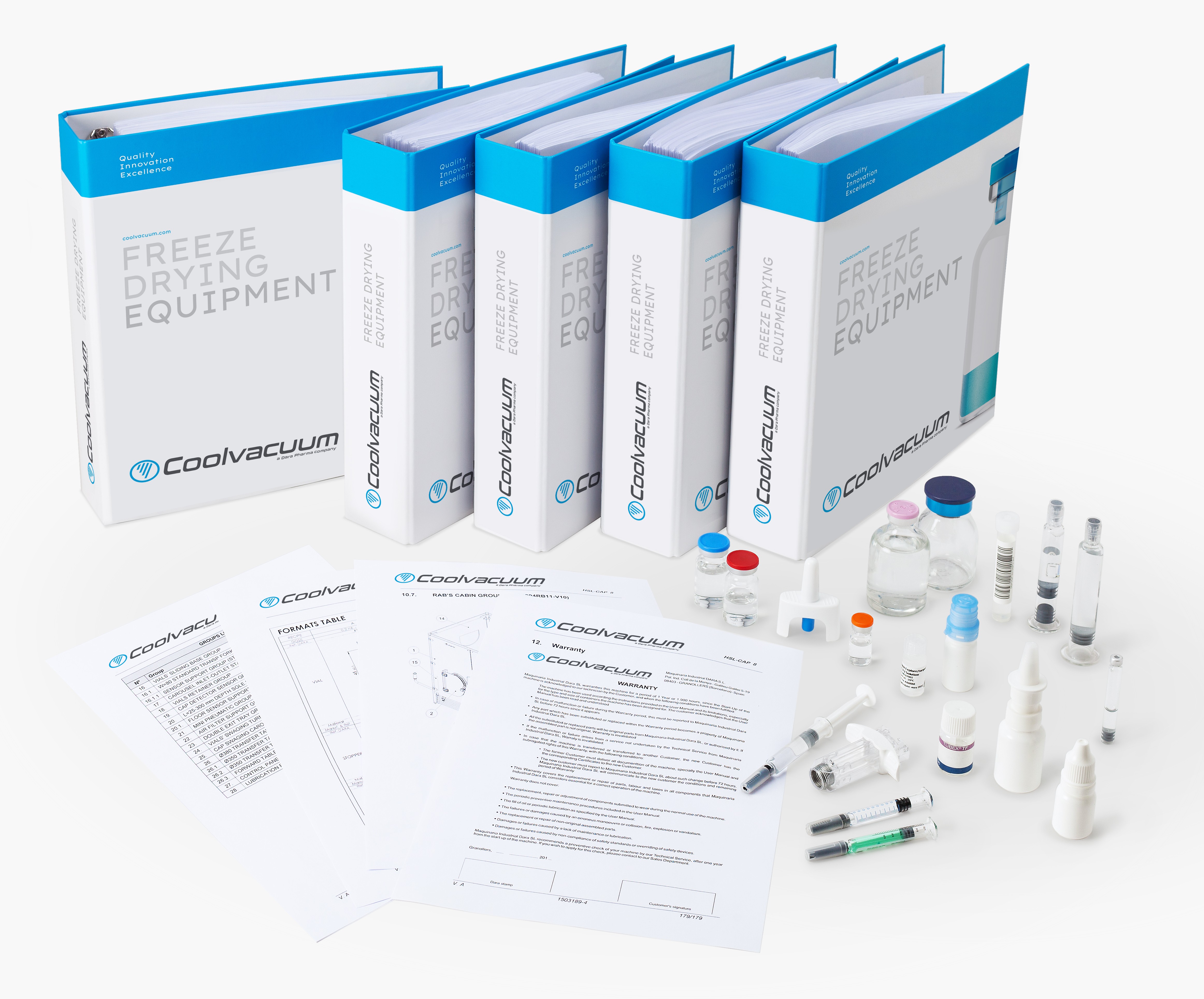
GMP 장비용 문서 패키지입니다.

품질 제어.
개인 데이터 보호에 관한 현행 법률 조항을 준수하여 본 양식을 작성함으로써 귀하의 개인 데이터가 Coolvacuum Technologies, SL (CIF: B-66345034) 당사의 서비스를 제공하고 웹 사이트 www.coolvacuum.com에서 선택한 옵션에 따라 정보를 전송합니다. 이 동의는 이러한 데이터 처리에 대한 정당성을 구성합니다. 개인 데이터는 정보 신청 또는 요청의 전체 과정 동안 또는 현행 법률에서 정한 기간 동안 보관되며, 수집 또는 등록된 목적과 더 이상 필요하지 않거나 관련이 없을 때 취소됩니다. 마찬가지로, 귀하는 산업단지 에 등록된 사무실로 언제든지 연락하여 귀하의 데이터에 대한 권리를 행사할 수 있음을 알려드립니다. Ind. Coll de la Manya - Galileo Galilei, 13 - 08403 Granollers (Barcelona, Spain) , 또는 이메일: lopd@coolvacuum.com. 개인정보보호정책에서 더 많은 정보확인하기 .


